Même pas peur du vaccin !

Les vaccins ont souvent suscité les craintes d’une partie de la population, ainsi à l’époque d’Edward Jenner et des premières vaccinations contre la variole, certains craignaient d’être transformés en animaux.
Phases cliniques de développement des vaccins
| Phases de développement | Echantillon (Divisé en 2 groupes si essai en double aveugle) | Activité |
| Essais pré-cliniques | Cellules In-Vitro, Rongeurs puis singes | Sélectionner les meilleurs candidats pour éviter d’administrer à des humains des vaccins inefficaces ou qui seraient trop inflammatoires |
| Essai clinique phase 1 | 10–100 volontaires | Tester la sécurité et l'immunogénicité d'un vaccin candidat chez quelques personnes à faible risque (généralement des adultes en bonne santé) afin de déterminer la tolérance |
| Essai clinique phase 2 | Plusieurs centaines de volontaires | Surveiller la sécurité, les effets secondaires potentiels, la réponse immunitaire et déterminer la posologie optimale ainsi que le calendrier vaccinal |
| Essai clinique phase 3 | Plusieurs (dizaines de) milliers de volontaires | Étudier l'efficacité clinique dans la prévention de la maladie et fournir plus d'informations sur la sécurité à partir d'une population plus hétérogène et des périodes d'observation plus longues |
| Demande d'autorisation | La demande d'autorisation est soumise aux autorités de réglementation afin qu'elles approuvent la commercialisation du vaccin selon les populations | |
| Phase 4 Vaccin commercialisé | Plusieurs millions de personnes | Observer si des effets secondaires indésirables rares, graves surviennent chez des millions de personnes vaccinées. Repréciser et réadapter l'utilisation du vaccin selon les populations |
Les 6 vaccins sélectionnés par l’UE
Aux USA la FDA conditionne la validation d’un vaccin à un objectif de protection d’au moins 50% (Guidance for Industry - Development and Licensure of Vaccines to Prevent COVID-19). A noter que celui de la grippe est évaluée entre 30 et 70%.
L’Union Européenne, à l’instar d’autres pays, s’est constituée un portefeuille de vaccins qu’elle a sécurisés en passant des contrats de précommande avec les laboratoires pharmaceutiques. En privilégiant ceux ayant des sites de production en Europe, elle en a finalement retenu 6 excluant les vaccins chinois et russe en fin de phase 3.
Ces livraisons n'interviendront toutefois que quand ces vaccins auront prouvé qu'ils sont sûrs et efficaces. La distribution de tout vaccin sera notamment suspendue au feu vert du régulateur, l'Agence européenne des médicaments (EMA).
Nationalité | Laboratoire | Type de vaccin | Efficacité en phase 3 | Précommande en millions de doses jusqu’à | Autorisation sur le marché de l'UE |
Allemagne/USA | BioNTech/Pfizer | A ARNm (2 injections) | > 95% | 200M + 100M | 21/12/2020 (Fr HAS 27/12/2020) |
USA | Moderna/NIAID1 | A ARNm (2 injections) | > 94,5% | 160 M | 06/01/2021 (Fr HAS 08/01/2021) |
USA | Johnson & Johnson (Jansen Pharmaceutica NV/BARDA1 | A vecteur viral (1 ou 2injections) | Phase 3 non terminée | 200M + 200M |
|
Suède/Royaume-Uni | AstraZeneca/Univ Oxford | A vecteur viral (2 injections)
| > 62%3 > 90%4 | 300 M + 100M | (GB 30/12/2020 Autorisation "d'urgence" ) UE demande info supplémentaires |
Allemagne | CureVac | ARNm | Phase 3 non terminée | 225M +180M |
|
France/Royaume-Uni | Sanofi/GSK2 | A protéine recombinante avec adjuvant (2 injections) | Phase 3 à venir et disponibilité vaccin fin 2.21 | 300 M |
|
| 1 Agence du HHS (Ministère Santé US) 2GlaxoSmithKline 3 2 injections (2 x 1 dose) 4 1ère injection 1/2 dose, seulement 3 000 volontaires < 55 ans => prolongation de la phase 3 avec ce dosage | |||||
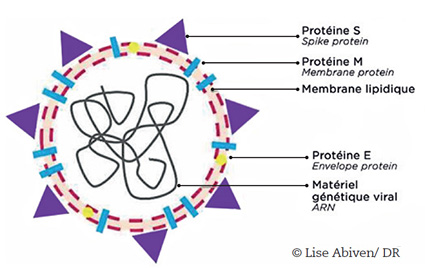
Principe : Les protéines S (Spike) exprimées par le coronavirus Sars-CoV-2 s’accrochent aux récepteurs ACE2 présents à la surface de cellules humaines notamment pulmonaires, lui permettant d’y pénétrer et de s’y multiplier. Les 6 vaccins sélectionnés par l’UE n’utilisent pas des virus atténués (vaccins chinois) mais des protéines S non pathogènes pour déclencher la réponse immunitaire conduisant à l’immunité. Elles sont soit injectées dans l’organisme (vaccin à protéine recombinante) soit fabriquées par les cellules humaines elles-mêmes (vaccin à virus recombinant et vaccin à ARNmessager)
- Vaccin à protéine recombinante : Sanofi utilise un baculovirus dont le génome a été modifié pour faire fabriquer des protéines S par des cellules d’insectes infectées. Ces protéines sont isolées et purifiées avant d'être injectées avec un adjuvant (GSK) qui amplifie la réponse immunitaire. Technique utilisée dans le vaccin de la grippe.
- Vaccin à virus recombinant (= à vecteur viral) : le vaccin d’Oxford–AstraZeneca est produit à partir d’un adenovirus vivant de chimpanzé génétiquement modifié (OGM) de façon qu’il ne soit plus pathogène et intègre dans son génome une partie codante pour faire fabriquer la protéine S par les cellules humaines infectées. Utilisé en thérapie génique sur un nombre limité de cas.
- Vaccins à ARN messager : si elles font l’objet de travaux depuis plusieurs années et présentent de nombreux avantages, ces technologies de vaccination (à ARNm ou à ADN) n’ont encore jamais été autorisées chez l’humain car dépourvues de recul. Ces vaccins se basent sur l'injection d'un ARN messager synthétisé chimiquement portant la séquence codante de la protéine S. Leur capsule lipidique potentialise les propriétés immunogènes des ARN. En principe, ils n'interagissent pas avec le génome puisque agissant exclusivement dans le cytoplasme(Ribosome). L’ARN étant peu stable requiert une chaine de froid rigoureuse (T= -80°C pour Pfizer).
